锂离子电池电化学原理
1.1.1 化学原理
这里以采用钴酸锂为正极材料、石墨为负极材料为例来介绍锂离子电池的化 学原理。在充电过程中,锂离子从正极中脱出,然后嵌入到负极石墨材料中,形 成锂离子的石墨嵌入化合物;而在放电过程中,锂离子从石墨嵌入化合物中脱 出,重新嵌入到正极材料中,如图1-1所示。锂离子电池充放电时,相当于锂离 子在正极和负极之间来回运动,因此锂离子电池最初被形象地称为 “摇椅式电 池”(rackingchairbattery)。
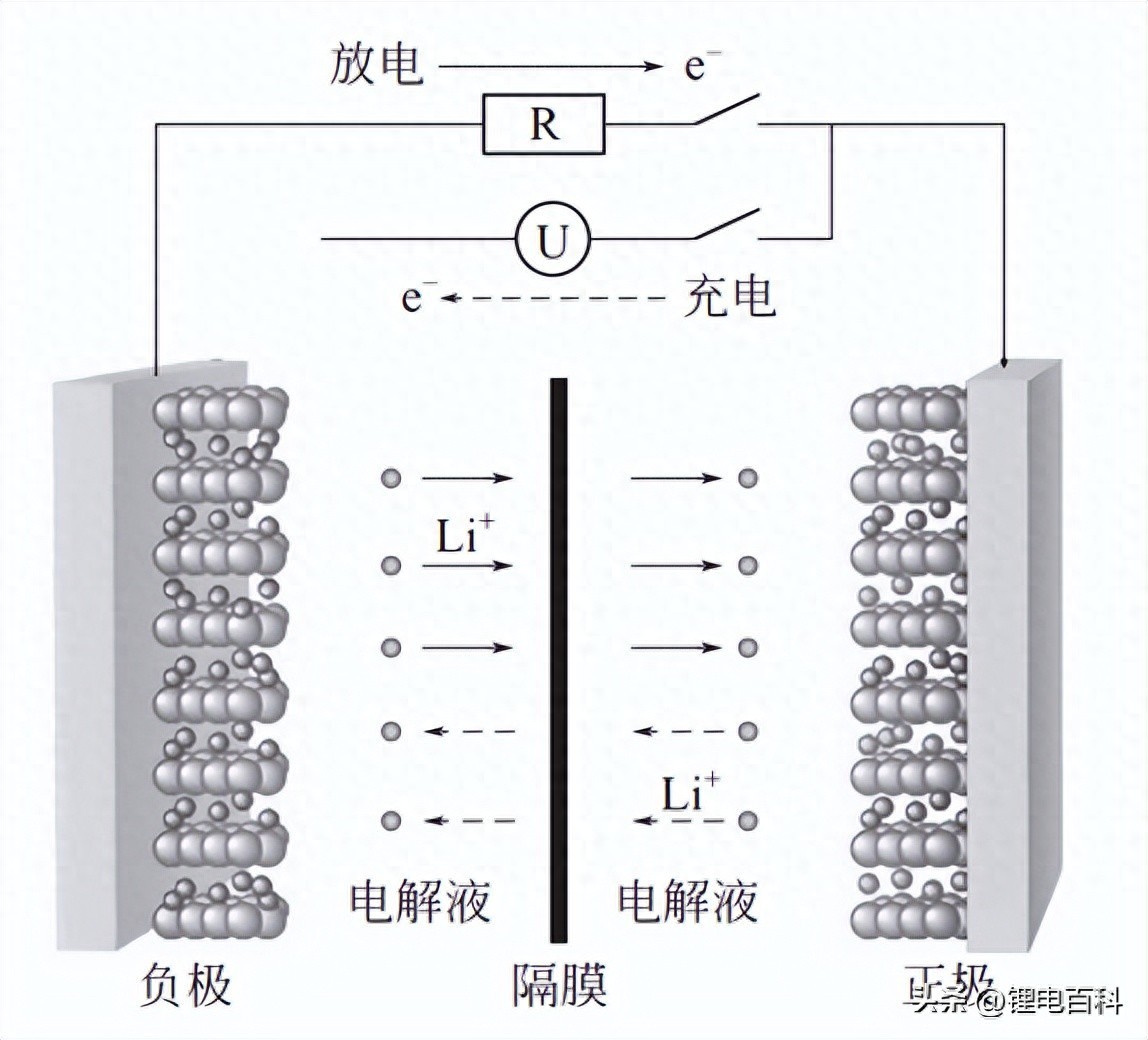
图1-1 锂离子电池反应原理图 (钴酸锂和石墨层状化合物)
锂离子电池在充放电时,正负极材料的化合价会发生变化。在常温常压下发 生总的氧化还原反应如下[1]:
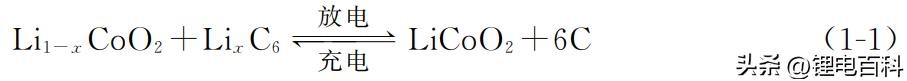
放电过程中的电极反应为:
正极 (还原反应,得电子)
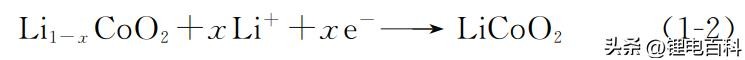
负极 (氧化反应,失电子)
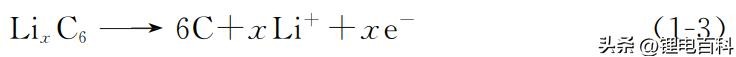
充电过程中的电极反应与上述式(1-2)、式(1-3)反应过程相反。 因此,当采用钴酸锂为正极材料和石墨为负极材料时,由于上述氧化还原反 应具有良好的可逆性,锂离子电池循环性能优异;由于石墨嵌锂化合物密度低, 锂离子电池质量比能量高;由于氧化还原电对 Li+/Li的电位在金属电对中最负, 锂离子电池的工作电压和比能量高。 由反应式(1-1)可 以 看 出,理 论 上 锂 离 子 电 池 的 正 负 极 活 性 物 质 分 别 为
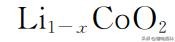
和
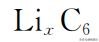
但是由于
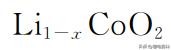
和
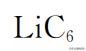
制备过程复杂,且在空气中不 稳定,难以直接制造电池。因此,人们通常采用反应式(1-1)的生成物钴酸锂和 石墨作为正负极原材料装配成电池,此时电池处于没有电的状态,只有充电以后 上述两种材料转化为活性物质才能自发放电,向外界提供电能。
来源:《锂离子电池制造工艺原理与应用》
注:本站转载的文章大部分收集于互联网,文章版权归原作者及原出处所有。文中观点仅供分享交流,如涉及版权等问题,请您告知,我将及时处理!
